백토서팁 골육종 치료제로 미국·유럽 희귀의약품 지정
Jul 28, 2023
당사가 개발 중인 백토서팁이 27일 골육종 치료제로 유럽 의약품청(EMA)로부터 희귀의약품(Orphan Medicinal Product Designation, OMPD)으로 지정 받음. 지난 2021년 미국 식품의약국(FDA)로부터 희귀의약품(Orphan Drug Designation, ODD)으로 지정 받은 이후 두번째 지정임.
골육종은 골격계의 악성 종양 중 하나로, 주로 어린이와 청소년에게 발생하는 경우가 많음. 골육종은 뼈에 발생하는 원발성 악성종양(암) 중에서 가장 흔한 암종으로, 왕성한 10대 성장기에 가장 많이 발생함. 발생 빈도는 미국의 경우 연간 500~1,000명 정도 발생하는 것으로 알려져 있고 우리나라에서도 연간 약 100명 정도 발생하는 것으로 추정되고 있음.
골육종은 현재 마땅한 치료제가 없이 수술, 항암 약물 치료, 방사선 치료 등의 일반적인 항암요법이 치료요법으로 활용되고 있음. 처음 진단 시 전이가 없는 골육종의 경우 대개 수술 전 항암 약물 치료, 종양 제거 수술, 수술 후 항암 약물 치료의 순서로 치료가 진행됨.
골육종은 전이 없이 암이 발생한 부위에만 국한된 경우와 전이가 있는 경우의 두 가지로 나뉘는데, 전이가 있는 경우가 대개 폐로 많이 전이됨. 골육종의 진단 시 20% 정도의 환자에서 전이가 발견되는 것으로 알려져 있음. 전이의 유무가 가장 중요하게 예후를 결정 짓는 인자로, 전이가 없는 경우 5년 생존율(진단 후 5년이 지났을 때 환자가 생존해 있을 확률)은 약 60~70%, 전이가 있는 경우는 5년 생존율이 약 20~30%임.
미국에 이어 유럽에서도 희귀의약품으로 지정된 만큼 성공적으로 임상이 진행될 경우 치료제 개발에 속도를 낼 것으로 기대됨.
- 미국과 유럽 등은 희귀의약품 지정 의약품에 대해 개발과정에서 개발비 직접 지원, 개발비에 대한 세액공제, 허가심사 수수료 감면 등의 재정적 혜택을 부여함. 신속 심사 프로그램을 통한 개발시간 단축도 지원. 희귀의약품이 신속 심사 프로그램의 대상으로 명시되어 있지는 않지만, 희귀의약품의 특성상 대상 조건에 부합하는 경우가 많아 대부분의 희귀의약품이 신속 심사 프로그램을 통해 시판허가를 받고 있음. EU의 경우 안전성 유효성에 관한 데이터가 충분하지 않더라도 긴급하게 시판허가해 제한적으로 사용될 수 있도록 하는 긴급허가제도를 운영하고 있음.

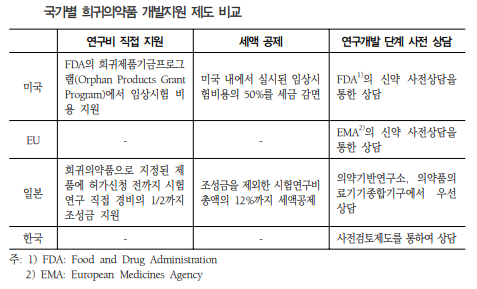
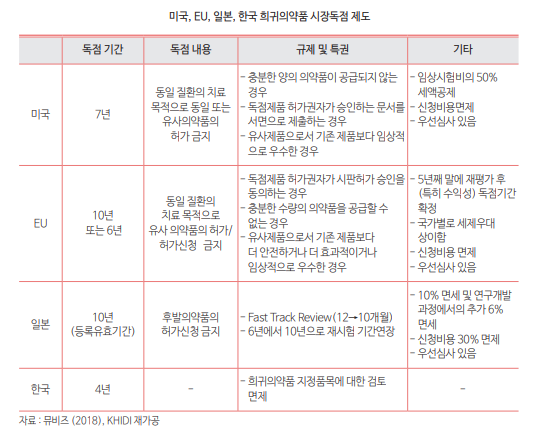
- 시판허가를 받은 희귀의약품에 대해서는 시장독점권을 부여하고 있음. 미국은 희귀의약품으로 지정된 의약품을 허가일로부터 7년간 동일 질환에서 동일 또는 유사한 의약품을 시판허가를 금지함. 이는 신약에 대해 부과된 신약독점기간 5년보다 긴 것으로, 희귀의약품 개발에 대해 그만큼 추가적인 인센티브가 제공됨을 알 수 있음. EU에서는 희귀의약품 시판허가가 나면, 10년 동안 유사한 의약품에 대해 동일한 적응증으로 시판허가 신청을 할 수 없음.
글로벌 시장에서 희귀의약품 연구개발은 항암 치료제가 주도하고 있음.
- 암치료에 대한 미충족 수요가 높고, 질병 발병 기전과 증상이 고도로 세분화되어 있어 환자 수가 적은 틈새 적응증이 많기 때문임. 2018년 FDA의 승인을 받은 희귀의약품은 34개 제품으로 이 중 약 38%인 13개의 제품이 항암 치료제
골육종 대상 백토서팁 단독요법은 희귀의약품 지정 외에 미국 FDA로부터 ‘희귀 소아질환 의약품(Rare Pediatric Disease Designation, RPDD), 신속 심사제도(Fast Track Designation, 패스트트랙) 개발 품목으로 지정 받음.
- FDA는 18세 이하 어린이와 20만명 미만의 사람들에게 주로 영향을 끼치는 심각하고 생명을 위협하는 질병에 대해 RPDD로 지정을 함. RPDD 지정을 받으면 소아희귀질환 치료신약 허가 특례에 따라 우선심사 바우처(PRV)를 신청할 수 있음. PRV는 FDA의 허가 심사를 6개월 내에 완료할 수 있도록 해주는 권리로, 다른 제품의 시판허가 절차에서 유용하게 사용할 수 있고 다른 회사에 판매 및 양도가 가능함. 실제로 우선심사 바우처(PRV)는 최근 약 1억 달러에 거래된 바 있음. 지난해 7월 스위스 제약회사인 노바티스는 맬린크로트(Mallinckrodt)로부터 1억 달러에 PRV를 구입했음.
- 패스트트랙 지정은 중증질환 치료제 등 중요 분야 신약을 환자에게 조기 공급하기 위한 목적으로 FDA가 시행하는 신약개발 촉진 절차 중 하나임. 해당되는 의약품은 ▲기존 치료법이 없는 질병의 치료 또는 예방을 목적으로 하는 신약 ▲기존 치료법이 있을 경우, 기존 치료법들과 비교하여 개선점을 입증하는 의약품 등임. 패스트트랙 지정 신약은 개발 각 단계마다 FDA로부터 다양한 지원을 받을 수 있음. FDA와의 긴밀한 협의를 통해 신약개발 과정이 일반적인 경우보다 더 신속히 진행되고, '롤링 리뷰(Rolling Review, 시판허가 신청 시 자료가 구비되는 대로 순차적 제출·검토)' 혜택이 부여됨. FDA와 '우선 심사(Priority Review, 시판허가 신청 시 FDA 검토 기간을 6개월로 단축)' 협의를 할 수도 있음.
지난해 미국 FDA로부터 치료목적사용(Compassionate Use, 동정적 사용) 승인을 받아 백토서팁을 단독투여한 골육종(뼈암) 환자가 폐와 뇌 전이 없이 일상생활을 하고 있음.
- 치료목적사용은 치료 대안이 없는 중증 환자 등의 치료를 위해 허가 받지 않은 의약품 또는 임상시험이 진행 중인 의약품을 사용할 수 있게 하는 제도임. 미국 케이스 웨스턴 리저브 대학(Case Western Reserve University) 레인보우 소아병원은 백토서팁의 전임상 데이터에 주목, 이를 근거로 미국 FDA로부터 치료목적사용 승인을 받아 지난해 2월 이 환자에게 백토서팁을 투여함. 호스피스 치료를 받아온 이 환자는 백토서팁 투여 후 부작용이나 합병증 없이 현재는 학교에 다닐 정도로 건강한 일상생활을 하고 있음.